Der Wert der spezifischen Verdampfungswärme von Salzsäure. Sieden. Spezifische Verdampfungswärme
Der Vorgang, bei dem ein Stoff vom flüssigen in den gasförmigen Zustand übergeht, wird als bezeichnet Verdampfung. Die Verdampfung kann in Form von zwei Prozessen durchgeführt werden: i.
Sieden
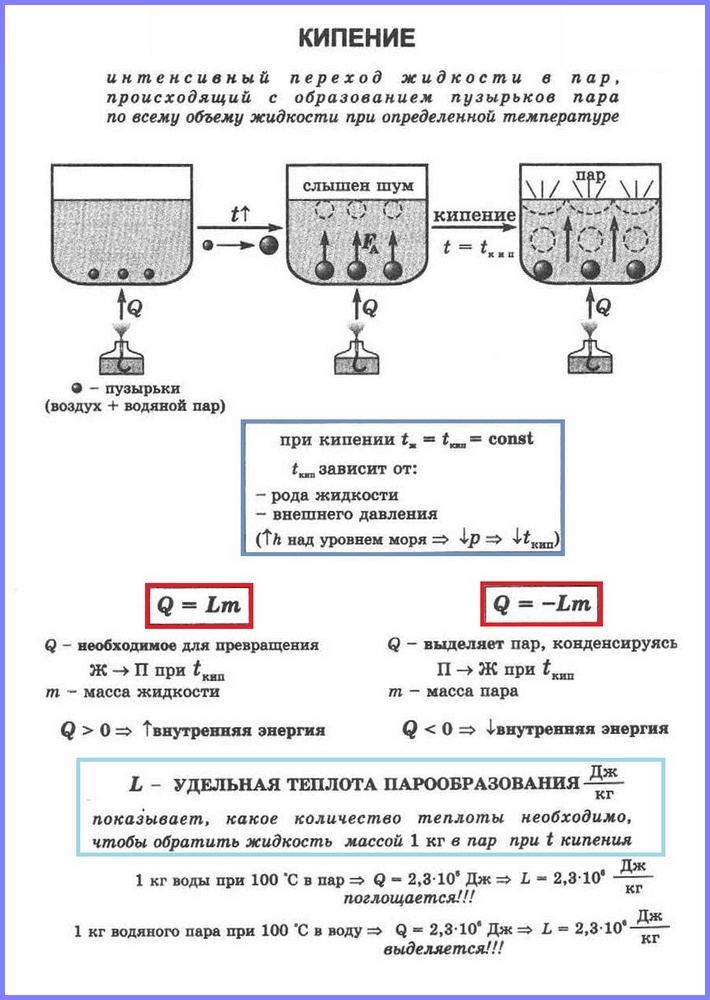
Der zweite Verdampfungsprozess ist das Sieden. Sie können diesen Vorgang mit beobachten einfache Erfahrung Erhitzen von Wasser in einem Glaskolben. Wenn Wasser erhitzt wird, entstehen nach einiger Zeit Blasen darin, die Luft und gesättigten Wasserdampf enthalten, der entsteht, wenn Wasser innerhalb der Blasen verdunstet. Wenn die Temperatur steigt, steigt der Druck in den Blasen, und unter der Wirkung der Auftriebskraft steigen sie auf. Da die Temperatur der oberen Wasserschichten jedoch niedriger ist als die der unteren, beginnt der Dampf in den Blasen zu kondensieren und sie schrumpfen. Wenn sich das Wasser im gesamten Volumen erwärmt, steigen die Dampfblasen an die Oberfläche, platzen und der Dampf tritt aus. Wasser kocht. Dies geschieht bei einer Temperatur, bei der der Druck gesättigter Dampf Blasen ist gleich dem atmosphärischen Druck.
Der Prozess der Verdampfung, der im gesamten Volumen einer Flüssigkeit bei einer bestimmten Temperatur auftritt, wird als bezeichnet. Man nennt die Temperatur, bei der eine Flüssigkeit siedet Siedepunkt.
Diese Temperatur hängt vom atmosphärischen Druck ab. Wenn der atmosphärische Druck steigt, steigt der Siedepunkt.
Die Erfahrung zeigt, dass sich die Temperatur der Flüssigkeit während des Siedevorgangs nicht ändert, obwohl Energie von außen zugeführt wird. Der Übergang eines flüssigen in einen gasförmigen Zustand am Siedepunkt ist mit einer Vergrößerung des Abstands zwischen den Molekülen und dementsprechend mit der Überwindung der Anziehung zwischen ihnen verbunden. Die dem Fluid zugeführte Energie wird aufgewendet, um die Anziehungskräfte zu überwinden. Dies geschieht, bis sich die gesamte Flüssigkeit in Dampf verwandelt. Da Flüssigkeit und Dampf beim Sieden die gleiche Temperatur haben, ist der Mittelwert kinetische Energie Moleküle ändert sich nicht, nur ihre potentielle Energie nimmt zu.
Die Figur zeigt ein Diagramm der Wassertemperatur über der Zeit während seiner Erwärmung von Raumtemperatur auf Sieden (AB), Sieden (BC), Dampferwärmung (CD), Dampfkühlung (DE), Kondensation (EF) und anschließender Abkühlung (FG).
Spezifische Verdampfungswärme
Für die Umwandlung verschiedener Stoffe vom flüssigen in den gasförmigen Zustand wird unterschiedliche Energie benötigt, diese Energie wird durch einen Wert charakterisiert, der als spezifische Verdampfungswärme bezeichnet wird.
Spezifische Wärme Verdampfung (L) ist ein Wert, der dem Verhältnis der Wärmemenge entspricht, die einem Stoff mit einer Masse von 1 kg zugeführt werden muss, um ihn am Siedepunkt vom flüssigen in den gasförmigen Zustand zu überführen.
Die Einheit der spezifischen Verdampfungswärme ist [ L] = J/kg.
Zur Berechnung der Wärmemenge Q, die einem Stoff der Masse mn für den Übergang vom flüssigen in den gasförmigen Zustand zugeführt werden muss, benötigt man die spezifische Verdampfungswärme ( L) mal Masse des Stoffes: Q = Lm.
Wenn Dampf kondensiert, wird eine bestimmte Wärmemenge freigesetzt, und ihr Wert entspricht dem Wert der Wärmemenge, die aufgewendet werden muss, um die Flüssigkeit bei derselben Temperatur in Dampf umzuwandeln.
Um das Sieden von Wasser (oder einer anderen Flüssigkeit) aufrechtzuerhalten, muss es kontinuierlich mit Wärme versorgt werden, beispielsweise um es mit einem Brenner zu erhitzen. In diesem Fall steigt die Temperatur des Wassers und des Gefäßes nicht an, aber es entsteht pro Zeiteinheit eine bestimmte Menge Dampf. Daraus folgt der Schluss, dass die Umwandlung von Wasser in Dampf eine Wärmezufuhr erfordert, ebenso wie sie bei der Umwandlung eines Kristalls (Eis) in eine Flüssigkeit stattfindet (§ 269). Die Wärmemenge, die erforderlich ist, um eine Einheitsmasse einer Flüssigkeit in Dampf derselben Temperatur umzuwandeln, wird als spezifische Verdampfungswärme einer gegebenen Flüssigkeit bezeichnet. Sie wird in Joule pro Kilogramm angegeben.
Es ist leicht einzusehen, dass die gleiche Wärmemenge freigesetzt werden muss, wenn ein Dampf zu einer Flüssigkeit kondensiert. Lassen Sie uns in der Tat ein mit einem Kessel verbundenes Rohr in ein Glas Wasser absenken (Abb. 488). Einige Zeit nach dem Beginn des Erhitzens beginnen Luftblasen aus dem in das Wasser getauchten Ende des Schlauchs zu entweichen. Diese Luft erhöht leicht die Temperatur des Wassers. Dann kocht das Wasser im Kessel, wonach wir sehen werden, dass die aus dem Ende des Rohrs austretenden Blasen nicht mehr aufsteigen, sondern schnell abnehmen und mit scharfer Ton verschwinden. Dies sind Dampfblasen, die zu Wasser kondensieren. Sobald statt Luft Dampf aus dem Boiler kommt, beginnt sich das Wasser schnell zu erhitzen. Als spezifische Wärme Dampf ist ungefähr dasselbe wie Luft, dann folgt aus dieser Beobachtung, dass eine so schnelle Erwärmung von Wasser genau aufgrund der Kondensation von Dampf erfolgt.

Reis. 488. Während Luft aus dem Kessel kommt, zeigt das Thermometer fast dieselbe Temperatur. Wenn anstelle von Luft Dampf austritt und in der Tasse zu kondensieren beginnt, steigt das Thermometer schnell an und zeigt einen Temperaturanstieg an.
Wenn eine Einheitsmasse Dampf zu einer Flüssigkeit gleicher Temperatur kondensiert, wird eine Wärmemenge freigesetzt, die der spezifischen Verdampfungswärme entspricht. Dies könnte auf der Grundlage des Energieerhaltungssatzes vorhergesehen werden. Wenn dem nicht so wäre, dann könnte man nämlich eine Maschine bauen, in der die Flüssigkeit zuerst verdampft und dann kondensiert: Die Differenz zwischen Verdampfungswärme und Kondensationswärme würde den Zuwachs der Gesamtenergie aller Körper darstellen Teilnahme an dem betreffenden Verfahren. Und das widerspricht dem Energieerhaltungssatz.
Die Bestimmung der spezifischen Verdampfungswärme kann ähnlich wie bei der Bestimmung der spezifischen Schmelzwärme (§ 269) mit einem Kalorimeter erfolgen. Gießen Sie eine bestimmte Menge Wasser in das Kalorimeter und messen Sie dessen Temperatur. Dann werden wir für einige Zeit Dampf der Testflüssigkeit aus dem Kessel in das Wasser einleiten und Maßnahmen ergreifen, um sicherzustellen, dass nur Dampf ohne Flüssigkeitstropfen fließt. Dazu wird Dampf durch einen Dämpfer geleitet (Abb. 489). Danach messen wir wieder die Wassertemperatur im Kalorimeter. Indem wir das Kalorimeter wiegen, können wir anhand der Zunahme seiner Masse die zu einer Flüssigkeit kondensierte Dampfmenge beurteilen.

Reis. 489. Sukhoparnik - ein Gerät zum Zurückhalten von Wassertropfen, die sich mit Dampf bewegen
Unter Verwendung des Energieerhaltungssatzes können wir eine Gleichung für diesen Prozess aufstellen Wärmebilanz, die es erlaubt, die spezifische Verdampfungswärme von Wasser zu bestimmen. Die Masse des Wassers im Kalorimeter (einschließlich des Wasseräquivalents des Kalorimeters) sei gleich der Dampfmasse - , der Wärmekapazität des Wassers - , der Anfangs- und Endtemperatur des Wassers im Kalorimeter - und , dem Siedepunkt von Wasser - und die spezifische Verdampfungswärme - . Die Wärmebilanzgleichung hat die Form
![]() .
.
Die Ergebnisse der Bestimmung der spezifischen Verdampfungswärme einiger Flüssigkeiten bei Normaldruck sind in der Tabelle angegeben. 20. Wie Sie sehen können, ist diese Hitze ziemlich groß. Die hohe Verdampfungswärme von Wasser spielt in der Natur eine äußerst wichtige Rolle, da die Verdampfungsprozesse in der Natur in grandiosem Ausmaß ablaufen.
Tabelle 20. Spezifische Verdampfungswärme einiger Flüssigkeiten
|
Substanz |
Substanz |
||
|
Äthanol) |
|||
Beachten Sie, dass sich die in der Tabelle enthaltenen Werte der spezifischen Verdampfungswärme auf den Siedepunkt beziehen Normaldruck. Wenn die Flüssigkeit bei einer anderen Temperatur siedet oder einfach verdampft, dann ist ihre spezifische Verdampfungswärme anders. Mit steigender Temperatur einer Flüssigkeit nimmt die Verdampfungswärme immer ab. Die Erklärung dafür sehen wir uns später an.
295.1. Berechnen Sie die Wärmemenge, die erforderlich ist, um 20 g Wasser bis zum Siedepunkt zu erhitzen und 20 g Wasser bei zu verdampfen.
295.2. Welche Temperatur wird erreicht, wenn 3 g Wasserdampf in ein Glas mit 200 g Wasser bei geleitet werden? Ignorieren Sie die Wärmekapazität des Glases.
Wir alle wissen, dass Wasser in einem Wasserkocher bei 100 °C kocht. Aber ist Ihnen aufgefallen, dass sich die Temperatur des Wassers während des Kochvorgangs nicht ändert? Die Frage ist: Wohin geht die erzeugte Energie, wenn wir den Container ständig in Brand halten? Es geht in die Umwandlung von Flüssigkeit in Dampf. Für den Übergang von Wasser in einen gasförmigen Zustand ist also eine konstante Wärmezufuhr erforderlich. Wie viel es braucht, um ein Kilogramm Flüssigkeit in Dampf gleicher Temperatur umzuwandeln, wird durch eine physikalische Größe bestimmt, die als spezifische Verdampfungswärme von Wasser bezeichnet wird.
Die physikalische Bedeutung der Menge
Kochen erfordert Energie. Das meiste davon wird zum Brechen verwendet chemische Bindungen zwischen Atomen und Molekülen, was zur Bildung von Dampfblasen führt, und der kleinere dehnt den Dampf aus, das heißt, damit die gebildeten Blasen platzen und ihn freisetzen können. Da die Flüssigkeit ihre ganze Energie in den Übergang in den gasförmigen Zustand steckt, erschöpfen sich ihre „Kräfte“. Zur ständigen Energieerneuerung und Verlängerung des Siedens muss dem Behälter mit Flüssigkeit immer mehr Wärme zugeführt werden. Ein Kessel, Gasbrenner oder irgendetwas anderes kann seinen Zufluss liefern. Heizgerät. Während des Kochens steigt die Temperatur der Flüssigkeit nicht an, es findet der Prozess der Dampfbildung mit der gleichen Temperatur statt.
Unterschiedliche Flüssigkeiten erfordern unterschiedlicher Betrag Wärme in Dampf umzuwandeln. Welche - zeigt die spezifische Verdampfungswärme.
Wie dieser Wert ermittelt wird, können Sie anhand eines Beispiels nachvollziehen. Nehmen Sie 1 Liter Wasser und bringen Sie es zum Kochen. Dann messen wir die Wärmemenge, die benötigt wird, um die gesamte Flüssigkeit zu verdampfen, und erhalten den Wert der spezifischen Verdampfungswärme für Wasser. Für andere Chemische Komponenten dieser Indikator wird anders sein.
In der Physik wird die spezifische Verdampfungswärme bezeichnet Lateinischer Buchstabe L. Es wird in Joule pro Kilogramm (J/kg) gemessen. Sie ergibt sich, indem man die beim Verdampfen aufgewendete Wärme durch die Masse der Flüssigkeit dividiert:
Dieser Wert ist sehr wichtig für Herstellungsprozesse aufgrund moderne Technologien. Sie orientieren sich zum Beispiel bei der Herstellung von Metallen daran. Es stellte sich heraus, dass, wenn Eisen geschmolzen und dann kondensiert wird, beim weiteren Härten ein stärkeres Kristallgitter entsteht.
Was ist gleich
Dabei wurde der Wert der spezifischen Wärme für verschiedene Substanzen (r) bestimmt Laborforschung. Wasser normal Luftdruck siedet bei 100 °C und die Verdampfungswärme von Wasser beträgt 2258,2 kJ/kg. Dieser Indikator für einige andere Stoffe ist in der Tabelle angegeben:
| Substanz | Siedepunkt, °C | r, kJ/kg |
|---|---|---|
| Stickstoff | -196 | 198 |
| Helium | -268,94 | 20,6 |
| Wasserstoff | -253 | 454 |
| Sauerstoff | -183 | 213 |
| Kohlenstoff | 4350 | 50000 |
| Phosphor | 280 | 400 |
| Methan | -162 | 510 |
| Pentan | 36 | 360 |
| Eisen | 2735 | 6340 |
| Kupfer | 2590 | 4790 |
| Zinn | 2430 | 2450 |
| Führen | 1750 | 8600 |
| Zink | 907 | 1755 |
| Quecksilber | 357 | 285 |
| Gold | 2 700 | 1 650 |
| Äthanol | 78 | 840 |
| Methylalkohol | 65 | 1100 |
| Chloroform | 61 | 279 |
Dieser Indikator kann sich jedoch unter dem Einfluss bestimmter Faktoren ändern:
- Temperatur. Wenn es zunimmt, nimmt die Verdampfungswärme ab und kann sein Null.
t, °C r, kJ/kg 2500 10 2477 20 2453 50 2380 80 2308 100 2258 200 1940 300 1405 374 115 374,15 - Druck. Mit sinkendem Druck steigt die Verdampfungswärme und umgekehrt. Der Siedepunkt ist direkt proportional zum Druck und kann einen kritischen Wert von 374 °C erreichen.
p, Pa Siedepunkt, °C r, kJ/kg 0,0123 10 2477 0,1234 50 2380 1 100 2258 2 120 2202 5 152 2014 10 180 1889 20 112 1638 50 264 1638 100 311 1316 200 366 585 220 373,7 184,8 Kritisch 221.29 374,15 - - Die Masse der Substanz. Die an dem Prozess beteiligte Wärmemenge ist direkt proportional zur Masse des entstehenden Dampfes.
Das Verhältnis von Verdunstung und Kondensation
Physiker haben herausgefunden, dass der umgekehrte Verdampfungsprozess - Kondensation - Dampf genau die gleiche Energiemenge verbraucht, die für seine Bildung aufgewendet wurde. Diese Beobachtung bestätigt den Energieerhaltungssatz.
Andernfalls wäre es möglich, eine Installation zu schaffen, in der die Flüssigkeit verdunstet und dann kondensiert. Die Differenz zwischen der für die Verdampfung erforderlichen Wärme und der für die Kondensation ausreichenden Wärme würde zu einer Akkumulation von Energie führen, die für andere Zwecke verwendet werden könnte. Tatsächlich würde ein Perpetuum Mobile entstehen. Dies widerspricht jedoch den physikalischen Gesetzen und ist daher unmöglich.
Wie wird gemessen
- Die spezifische Verdampfungswärme von Wasser wird experimentell in physikalischen Laboratorien gemessen. Dazu werden Kalorimeter verwendet. Das Verfahren ist wie folgt:
- Eine bestimmte Menge Flüssigkeit wird in das Kalorimeter gegossen.
Kochen ist eine intensive Verdampfung, die auftritt, wenn eine Flüssigkeit nicht nur von der Oberfläche, sondern auch in ihr erhitzt wird.
Sieden tritt unter Wärmeaufnahme auf.
Großer Teil der zugeführten Wärme wird zum Aufbrechen der Bindungen zwischen den Partikeln der Substanz aufgewendet, der Rest wird für die Arbeit aufgewendet, die während der Expansion des Dampfes verrichtet wird.
Als Ergebnis wird die Wechselwirkungsenergie zwischen Dampfpartikeln größer als zwischen Flüssigkeitspartikeln, so dass die innere Energie des Dampfes größer ist als die innere Energie der Flüssigkeit bei derselben Temperatur.
Die Wärmemenge, die benötigt wird, um eine Flüssigkeit während des Siedevorgangs in Dampf umzuwandeln, kann mit der Formel berechnet werden:

wobei m die Masse der Flüssigkeit (kg) ist,
L ist die spezifische Verdampfungswärme.
Die spezifische Verdampfungswärme gibt an, wie viel Wärme benötigt wird, um 1 kg eines bestimmten Stoffes am Siedepunkt in Dampf zu verwandeln. Die Einheit der spezifischen Verdampfungswärme im SI-System:
[L] = 1 J/kg
Mit steigendem Druck steigt der Siedepunkt der Flüssigkeit und die spezifische Verdampfungswärme sinkt und umgekehrt.

Während des Kochens ändert sich die Temperatur der Flüssigkeit nicht.
Der Siedepunkt hängt vom Druck ab, der auf die Flüssigkeit ausgeübt wird.
Jeder Stoff hat bei gleichem Druck seinen eigenen Siedepunkt.
Mit zunehmendem Atmosphärendruck beginnt das Sieden bei mehr hohe Temperatur, umgekehrt, wenn der Druck abnimmt.
Beispielsweise siedet Wasser bei 100°C nur bei normalem atmosphärischem Druck.
WAS PASSIERT BEIM KOCHEN IN DER FLÜSSIGKEIT?

Sieden ist der Übergang einer Flüssigkeit in Dampf mit der kontinuierlichen Bildung und dem Wachstum von Dampfblasen in der Flüssigkeit, in denen die Flüssigkeit verdampft. Zu Beginn des Aufheizens ist das Wasser mit Luft gesättigt und hat Raumtemperatur. Beim Erhitzen von Wasser wird das darin gelöste Gas am Boden und an den Wänden des Gefäßes freigesetzt und bildet Luftblasen. Sie beginnen lange vor dem Kochen zu erscheinen. In diese Blasen verdunstet Wasser. Eine mit Dampf gefüllte Blase beginnt sich bei einer ausreichend hohen Temperatur aufzublasen.

Erreichen bestimmte Größen es löst sich vom Boden, steigt an die Wasseroberfläche und platzt. In diesem Fall verlässt der Dampf die Flüssigkeit. Wird das Wasser nicht ausreichend erhitzt, kollabiert die in die kalten Schichten aufsteigende Dampfblase. Die daraus resultierenden Wasserschwankungen führen dazu, dass im gesamten Wasservolumen eine Vielzahl kleiner Luftblasen entstehen: der sogenannte „weiße Schlüssel“.

Eine Luftblase mit einem Volumen am Boden des Gefäßes wirkt Hubkraft:
Fpod \u003d Farchimede - Fgravity
Die Blase wird nach unten gedrückt, da auf die Unterseite keine Druckkräfte wirken. Beim Erhitzen dehnt sich die Blase aufgrund der Freisetzung von Gas aus und bricht vom Boden ab, wenn die Hebekraft etwas größer als die Druckkraft ist. Die Größe einer Blase, die sich vom Boden lösen kann, hängt von ihrer Form ab. Die Form der Blasen am Boden wird durch die Benetzbarkeit des Gefäßbodens bestimmt.
Benetzungsinhomogenität und Verschmelzung der Blasen am Boden führten zu einer Vergrößerung ihrer Größe. Beim große Größen Wenn dahinter eine Blase aufsteigt, entstehen Hohlräume, Lücken und Wirbel.
Wenn die Blase platzt, strömt die gesamte Flüssigkeit, die sie umgibt, nach innen, und es entsteht eine ringförmige Welle. Beim Schließen wirft sie eine Wassersäule hoch.

Wenn Blasen in einer Flüssigkeit platzen, breiten sich Stoßwellen mit Ultraschallfrequenzen aus, begleitet von hörbaren Geräuschen. Für Anfangsstadien Das Kochen ist durch die lautesten und höchsten Töne gekennzeichnet (auf der Stufe der "weißen Taste" "singt" der Wasserkocher).
(Quelle: virlib.eunnet.net)
TEMPERATURGRAFIK VON ÄNDERUNGEN IN DEN GESAMTSTAATEN DES WASSERS

SIEH DIR DAS BÜCHERREGAL AN!
INTERESSANT
Warum ist im Deckel der Teekanne ein Loch?
Um Dampf abzulassen. Ohne ein Loch im Deckel kann Dampf Wasser über den Ausguss des Wasserkochers schwappen.
___
Die Dauer des Kochens von Kartoffeln ab dem Moment des Kochens hängt nicht von der Leistung der Heizung ab. Die Dauer wird durch die Verweilzeit des Produktes am Siedepunkt bestimmt.
Die Leistung der Heizung beeinflusst nicht den Siedepunkt, sondern nur die Geschwindigkeit der Wasserverdampfung.
Durch Kochen kann Wasser gefrieren. Dazu müssen Luft und Wasserdampf aus dem Gefäß, in dem sich das Wasser befindet, abgepumpt werden, damit das Wasser ständig kocht.
"Töpfe kochen leicht über den Rand - bei schlechtem Wetter!"
Der mit schlechter werdendem Wetter einhergehende Luftdruckabfall ist der Grund dafür, dass die Milch schneller „wegläuft“.
___
Sehr heißes kochendes Wasser kann am Boden tiefer Minen gewonnen werden, wo der Luftdruck viel größer ist als auf der Erdoberfläche. In einer Tiefe von 300 m siedet Wasser also bei 101 °C. Bei einem Luftdruck von 14 Atmosphären siedet Wasser bei 200 °C.
Unter der Glocke der Luftpumpe können Sie bei 20 ͦ C "kochendes Wasser" bekommen.
Auf dem Mars würden wir „kochendes Wasser“ bei 45 C trinken.
Salzwasser siedet über 100 ͦ C. ___
In Bergregionen in beträchtlicher Höhe, bei reduziertem atmosphärischem Druck, siedet Wasser bei Temperaturen unter 100 ͦ Celsius.

Das Warten auf die Zubereitung einer solchen Mahlzeit dauert länger.
Gießen Sie es kalt ... und es wird kochen!
Normalerweise kocht Wasser bei 100 Grad Celsius. Erhitze das Wasser im Kolben auf dem Brenner zum Kochen. Lassen Sie uns den Brenner ausschalten. Das Wasser hört auf zu kochen. Wir verschließen die Flasche mit einem Stopfen und fangen an, vorsichtig kaltes Wasser auf den Stopfen zu gießen. Was ist es? Das Wasser kocht wieder!
..............................unter dem Strahl kaltes Wasser etwas Wasser in den Kolben, und damit beginnt der Wasserdampf abzukühlen.
Das Dampfvolumen nimmt ab und der Druck über der Wasseroberfläche ändert sich...
Was meint ihr, in welche Richtung?
... Der Siedepunkt von Wasser bei reduziertem Druck beträgt weniger als 100 Grad, und das Wasser im Kolben kocht wieder!
____
Beim Kochen beträgt der Druck im Topf - "Schnellkochtopf" - etwa 200 kPa, und die Suppe in einem solchen Topf kocht viel schneller.
Sie können bis etwa zur Hälfte Wasser in die Spritze aufziehen, mit dem gleichen Korken verschließen und kräftig am Kolben ziehen. Viele Blasen erscheinen im Wasser, was darauf hinweist, dass der Prozess des Kochens von Wasser begonnen hat (und das bei Raumtemperatur!).
___
Wenn ein Stoff in einen gasförmigen Zustand übergeht, nimmt seine Dichte um etwa das 1000-fache ab.
___
Die ersten elektrischen Wasserkocher hatten Heizungen unter dem Boden. Das Wasser kam nicht mit der Heizung in Berührung und kochte sehr lange. 1923 machte Arthur Large eine Entdeckung: Er platzierte einen Heizer in einem speziellen Kupferrohr und platzierte es im Inneren des Wasserkochers. Das Wasser kochte schnell.
In den USA wurden selbstkühlende Dosen für Erfrischungsgetränke entwickelt. Im Gefäß ist ein Fach mit einer niedrigsiedenden Flüssigkeit angebracht. Wenn Sie die Kapsel an einem heißen Tag zerdrücken, beginnt die Flüssigkeit schnell zu kochen, wodurch dem Inhalt des Glases Wärme entzogen wird, und in 90 Sekunden sinkt die Temperatur des Getränks um 20-25 Grad Celsius.
WIESO DEN?
Glauben Sie, dass es möglich ist, ein Ei hart zu kochen, wenn das Wasser bei einer Temperatur von weniger als 100 Grad Celsius kocht?
____
Wird Wasser in einem Topf kochen, der in einem anderen Topf mit kochendem Wasser schwimmt?
Wieso den? ___
Kann man Wasser zum Kochen bringen, ohne es zu erhitzen?

Sieden ist, wie wir gesehen haben, auch Verdunstung, nur geht es mit der schnellen Bildung und dem Wachstum von Dampfblasen einher. Es ist offensichtlich, dass es beim Kochen notwendig ist, der Flüssigkeit eine gewisse Wärmemenge zuzuführen. Diese Wärmemenge geht in die Dampfbildung über. Außerdem benötigen unterschiedliche Flüssigkeiten derselben Masse unterschiedliche Wärmemengen, um sie am Siedepunkt in Dampf umzuwandeln.
Experimente haben gezeigt, dass die Verdampfung von 1 kg Wasser bei einer Temperatur von 100 °C 2,3 x 10 6 J Energie benötigt. Für die Verdampfung von 1 kg Ether bei einer Temperatur von 35 °C werden 0,4 10 6 J Energie benötigt.
Damit sich die Temperatur der verdampfenden Flüssigkeit nicht ändert, muss der Flüssigkeit daher eine gewisse Wärmemenge zugeführt werden.
Die physikalische Größe, die angibt, wie viel Wärme benötigt wird, um eine Flüssigkeit der Masse 1 kg bei unveränderter Temperatur in Dampf zu verwandeln, heißt spezifische Verdampfungswärme.
Die spezifische Verdampfungswärme wird mit dem Buchstaben L bezeichnet. Ihre Einheit ist 1 J / kg.
Experimente haben ergeben, dass die spezifische Verdampfungswärme von Wasser bei 100 °C 2,3 10 6 J/kg beträgt. Mit anderen Worten, es werden 2,3 x 10 6 J Energie benötigt, um 1 kg Wasser bei einer Temperatur von 100 °C in Dampf umzuwandeln. Daher ist am Siedepunkt die innere Energie eines Stoffes im Dampfzustand größer als die innere Energie der gleichen Stoffmasse im flüssigen Zustand.
Tabelle 6
Spezifische Verdampfungswärme bestimmter Stoffe (bei Siedepunkt und normalem Atmosphärendruck)
Bei Kontakt mit einem kalten Gegenstand kondensiert Wasserdampf (Abb. 25). Dabei wird die bei der Dampfbildung aufgenommene Energie freigesetzt. Genaue Experimente zeigen, dass Dampf beim Kondensieren die Energiemenge abgibt, die bei seiner Entstehung aufgewendet wurde.

Reis. 25. Dampfkondensation
Wenn also 1 kg Wasserdampf bei einer Temperatur von 100 °C in Wasser gleicher Temperatur umgewandelt wird, werden 2,3 x 10 6 J Energie freigesetzt. Wie aus einem Vergleich mit anderen Stoffen ersichtlich ist (Tabelle 6), ist diese Energie recht hoch.
Die bei der Kondensation von Dampf frei werdende Energie kann genutzt werden. In großen Wärmekraftwerken erhitzt der Dampf, der in den Turbinen verwendet wird, Wasser.
Das so erwärmte Wasser wird zum Heizen von Gebäuden, in Bädern, Wäschereien und für andere Haushaltszwecke verwendet.
Um die Wärmemenge Q zu berechnen, die erforderlich ist, um eine Flüssigkeit beliebiger Masse am Siedepunkt in Dampf umzuwandeln, müssen Sie die spezifische Verdampfungswärme L mit der Masse m multiplizieren:
Aus dieser Formel kann das bestimmt werden
m=Q/L, L=Q/m
Die Wärmemenge, die durch am Siedepunkt kondensierenden Dampf der Masse m freigesetzt wird, wird nach der gleichen Formel bestimmt.
Beispiel. Wie viel Energie wird benötigt, um 2 kg Wasser bei 20 °C in Dampf zu verwandeln? Lassen Sie uns die Bedingung des Problems aufschreiben und es lösen.

Fragen
- Welche Energie wird der Flüssigkeit beim Kochen zugeführt?
- Was ist die spezifische Verdampfungswärme?
- Wie kann man experimentell zeigen, dass beim Kondensieren von Dampf Energie freigesetzt wird?
- Welche Energie wird von 1 kg Wasserdampf bei der Kondensation freigesetzt?
- Wo wird in der Technik die bei der Kondensation von Wasserdampf frei werdende Energie genutzt?
Übung 16
- Wie soll man verstehen, dass die spezifische Verdampfungswärme von Wasser 2,3 10 6 J/kg beträgt?
- Wie soll man verstehen, dass die spezifische Kondensationswärme von Ammoniak 1,4 10 6 J/kg beträgt?
- Welcher der in Tabelle 6 aufgeführten Stoffe hat bei der Umwandlung vom flüssigen in den Dampfzustand eine stärkere Zunahme der inneren Energie? Begründen Sie die Antwort.
- Wie viel Energie wird benötigt, um 150 g Wasser bei 100 °C in Dampf zu verwandeln?
- Wie viel Energie muss aufgewendet werden, um Wasser der Masse 5 kg, genommen bei einer Temperatur von 0 °C, zum Sieden zu bringen und zu verdampfen?
- Welche Energiemenge setzt Wasser der Masse 2 kg frei, wenn es von 100 auf 0 °C abgekühlt wird? Welche Energiemenge wird freigesetzt, wenn wir statt Wasser die gleiche Menge Dampf bei 100 °C nehmen?
Die Übung
- Bestimmen Sie nach Tabelle 6, bei welchen Stoffen beim Übergang vom flüssigen in den Dampfzustand die innere Energie stärker ansteigt. Begründen Sie die Antwort.
- Bereiten Sie einen Bericht zu einem der Themen vor (optional).
- Wie Tau, Reif, Regen und Schnee entstehen.
- Der Wasserkreislauf in der Natur.
- Metallguss.
