Vrijednost specifične topline isparavanja hlorovodonične kiseline. Vrenje. Specifična toplota isparavanja
Proces promjene tvari iz tekućeg u plinovito stanje naziva se isparavanje. Vaporizacija se može izvesti u obliku dva procesa: i.
Vrenje
Drugi proces isparavanja je ključanje. Ovaj proces možete pratiti sa jednostavno iskustvo zagrijavanje vode u staklenoj tikvici. Kada se voda zagrije, u njoj se nakon nekog vremena pojavljuju mjehurići koji sadrže zrak i zasićenu vodenu paru koja nastaje prilikom isparavanja vode unutar mjehurića. Kada temperatura poraste, pritisak unutar mjehurića raste, a pod djelovanjem sile uzgona oni se podižu. Međutim, pošto je temperatura gornjih slojeva vode niža od donjih, para u mjehurićima počinje da se kondenzuje i oni se skupljaju. Kada se voda zagrije u cijeloj zapremini, mjehurići s parom se dižu na površinu, pucaju i para izlazi. Voda ključa. To se dešava na temperaturi na kojoj je pritisak zasićena para mjehurića jednak je atmosferskom pritisku.
Proces isparavanja koji se odvija u cijeloj zapremini tečnosti na određenoj temperaturi naziva se. Temperatura na kojoj tečnost ključa se naziva tačka ključanja.
Ova temperatura zavisi od atmosferskog pritiska. Kako atmosferski pritisak raste, temperatura ključanja raste.
Iskustvo pokazuje da se tokom procesa ključanja temperatura tečnosti ne menja, uprkos činjenici da energija dolazi spolja. Prijelaz tekućine u plinovito stanje na tački ključanja povezan je s povećanjem udaljenosti između molekula i, shodno tome, sa prevladavanjem privlačenja između njih. Energija dovedena u tečnost se troši da izvrši rad savladavanja sila privlačenja. To se dešava sve dok se sva tečnost ne pretvori u paru. Pošto tečnost i para imaju istu temperaturu tokom ključanja, prosečna kinetička energija molekula se ne mijenja, samo im se povećava potencijalna energija.
Na slici je prikazan grafik temperature vode u zavisnosti od vremena tokom njenog zagrijavanja od sobne temperature do ključanja (AB), ključanja (BC), parnog grijanja (CD), hlađenja parom (DE), kondenzacije (EF) i naknadnog hlađenja (FG).
Specifična toplota isparavanja
Za transformaciju različitih tvari iz tekućeg u plinovito stanje potrebna je različita energija, koju karakterizira vrijednost koja se zove specifična toplina isparavanja.
Specifična toplota isparavanje (L) je vrijednost jednaka omjeru količine topline koja se mora prenijeti tvari mase 1 kg da se ona prevede iz tekućeg u plinovito stanje na tački ključanja.
Jedinica specifične toplote isparavanja je [ L] = J/kg.
Da bi se izračunala količina toplote Q, koja se mora preneti supstanci mase mn za njenu transformaciju iz tekućeg u gasovito stanje, potrebno je imati specifičnu toplotu isparavanja ( L) puta mase supstance: Q = Lm.
Kada se para kondenzuje, oslobađa se određena količina toplote, a njena vrednost je jednaka vrednosti količine toplote koja se mora potrošiti da se tečnost pretvori u paru na istoj temperaturi.
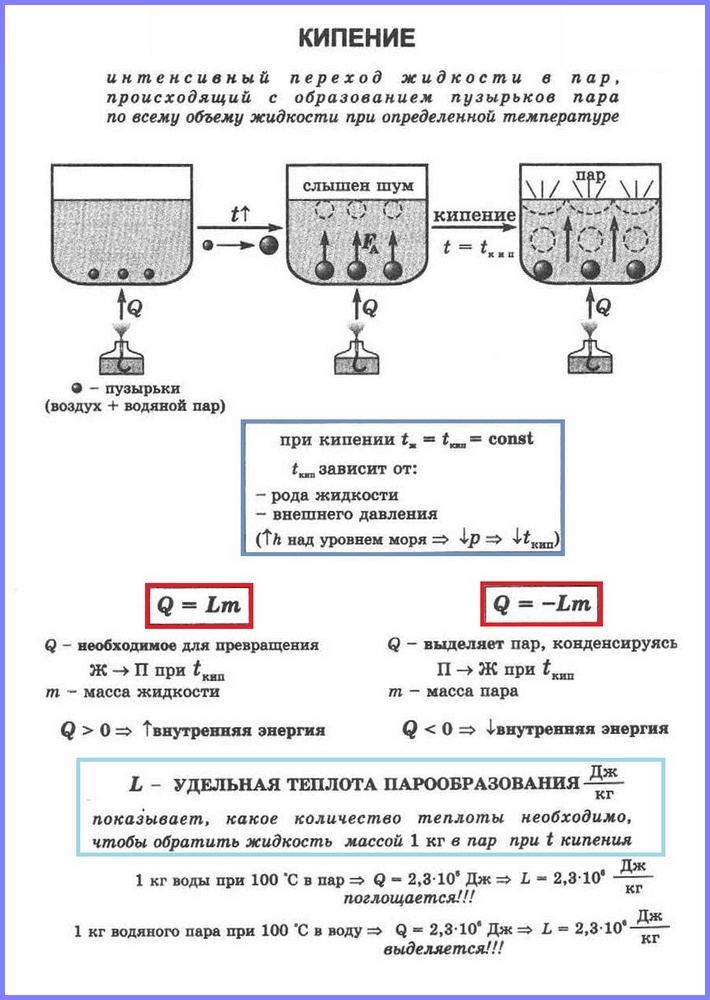
Da bi se održalo ključanje vode (ili druge tekućine), potrebno joj je kontinuirano dopremati toplinu, na primjer, zagrijati je plamenikom. U tom slučaju temperatura vode i posude ne raste, ali se stvara određena količina pare za svaku jedinicu vremena. Iz ovoga sledi zaključak da je za pretvaranje vode u paru potreban priliv toplote, baš kao što se to dešava prilikom pretvaranja kristala (leda) u tečnost (§ 269). Količina topline potrebna za pretvaranje jedinice mase tečnosti u paru iste temperature naziva se specifična toplota isparavanja date tečnosti. Izražava se u džulima po kilogramu.
Lako je uočiti da se ista količina toplote mora osloboditi kada se para kondenzuje u tečnost. Zaista, spustimo cijev spojenu na kotao u čašu vode (Sl. 488). Neko vrijeme nakon početka zagrijavanja, mjehurići zraka će početi izlaziti iz kraja cijevi umočenog u vodu. Ovaj vazduh blago podiže temperaturu vode. Tada voda u kotlu proključa, nakon čega ćemo vidjeti da se mjehurići koji izlaze iz kraja cijevi više ne dižu, već se brzo smanjuju i oštar zvuk nestati. To su mjehurići pare koji se kondenziraju u vodu. Čim para izađe iz kotla umjesto zraka, voda će se početi brzo zagrijavati. As specifična toplota para je približno ista kao i zrak, onda iz ovog zapažanja proizlazi da se tako brzo zagrijavanje vode događa upravo zbog kondenzacije pare.

Rice. 488. Dok zrak izlazi iz kotla, termometar pokazuje skoro istu temperaturu. Kada para izađe umjesto zraka i počne se kondenzirati u čaši, termometar će brzo porasti, što ukazuje na povećanje temperature.
Kada se jedinica mase pare kondenzuje u tečnost iste temperature, oslobađa se količina toplote jednaka specifičnoj toploti isparavanja. To bi se moglo predvidjeti na osnovu zakona održanja energije. Zaista, da nije tako, tada bi bilo moguće izgraditi mašinu u kojoj bi tečnost prvo isparila, a zatim se kondenzovala: razlika između toplote isparavanja i toplote kondenzacije predstavljala bi povećanje ukupne energije svih tela. učestvovanje u procesu koji se razmatra. A to je u suprotnosti sa zakonom održanja energije.
Specifična toplota isparavanja može se odrediti pomoću kalorimetra, slično kao što se radi pri određivanju specifične toplote fuzije (§ 269). Sipajte određenu količinu vode u kalorimetar i izmjerite njegovu temperaturu. Zatim ćemo, neko vrijeme, u vodu uvoditi paru ispitne tekućine iz kotla, poduzimajući mjere da struji samo para, bez kapljica tekućine. Da bi se to učinilo, para se propušta kroz parni aparat (Sl. 489). Nakon toga ponovo mjerimo temperaturu vode u kalorimetru. Vaganjem kalorimetra, po povećanju njegove mase možemo suditi o količini pare kondenzovane u tečnost.

Rice. 489. Sukhoparnik - uređaj za zadržavanje kapljica vode koje se kreću zajedno sa parom
Koristeći zakon održanja energije, možemo sastaviti jednačinu za ovaj proces toplotni bilans, što omogućava određivanje specifične topline isparavanja vode. Neka masa vode u kalorimetru (uključujući vodeni ekvivalent kalorimetra) bude jednaka masi pare - , toplotnom kapacitetu vode - , početnoj i konačnoj temperaturi vode u kalorimetru - i tački ključanja voda - i specifična toplota isparavanja - . Jednačina toplotnog bilansa ima oblik
![]() .
.
Rezultati određivanja specifične toplote isparavanja nekih tečnosti pri normalnom pritisku dati su u tabeli. 20. Kao što vidite, ova vrućina je prilično velika. Visoka toplota isparavanja vode igra izuzetno važnu ulogu u prirodi, budući da se procesi isparavanja odvijaju u prirodi u velikim razmjerima.
Tabela 20. Specifična toplota isparavanja nekih tečnosti
|
Supstanca |
Supstanca |
||
|
etanol) |
|||
Imajte na umu da se vrijednosti specifične topline isparavanja sadržane u tabeli odnose na tačku ključanja pri normalan pritisak. Ako tečnost ključa ili jednostavno isparava na drugoj temperaturi, tada je njena specifična toplota isparavanja drugačija. Kako temperatura tečnosti raste, toplota isparavanja se uvek smanjuje. Kasnije ćemo pogledati objašnjenje za ovo.
295.1. Izračunajte količinu topline koja je potrebna za zagrijavanje 20 g vode do točke ključanja i pretvaranje 20 g vode u paru na .
295.2. Koja će se temperatura postići ako se 3 g pare unese u čašu koja sadrži 200 g vode na ? Zanemarite toplotni kapacitet stakla.
Svi znamo da voda u kotliću ključa na 100°C. Ali jeste li primijetili da se temperatura vode ne mijenja tokom procesa ključanja? Postavlja se pitanje - kuda odlazi generirana energija ako posudu stalno držimo u plamenu? Ulazi u pretvaranje tečnosti u paru. Dakle, za prijelaz vode u plinovito stanje potrebna je stalna opskrba toplinom. Koliko je potrebno da se kilogram tekućine pretvori u paru iste temperature određuje fizička veličina koja se zove specifična toplina isparavanja vode.
Fizičko značenje količine
Za ključanje je potrebna energija. Većina se koristi za razbijanje hemijske veze između atoma i molekula, što za posljedicu ima stvaranje mjehurića pare, a onaj manji ide na širenje pare, odnosno tako da formirani mjehurići mogu puknuti i osloboditi je. Pošto tečnost svu svoju energiju stavlja u prelazak u gasovito stanje, njene "sile" ponestaju. Za stalno obnavljanje energije i produženje ključanja, u posudu sa tečnošću mora se unositi sve više toplote. Kotao, plinski gorionik ili bilo koji drugi može obezbijediti njegov dotok. uređaj za grijanje. Tokom ključanja temperatura tečnosti se ne povećava, odvija se proces stvaranja pare iste temperature.
Potrebne su različite tečnosti različit iznos toplotu da se pretvori u paru. Koji - pokazuje specifičnu toplotu isparavanja.
Možete razumjeti kako se ova vrijednost određuje iz primjera. Uzmite 1 litar vode i prokuhajte. Zatim mjerimo količinu toplote koja je potrebna da ispari sva tečnost i dobijamo vrednost specifične toplote isparavanja za vodu. Za druge hemijska jedinjenja ovaj indikator će biti drugačiji.
U fizici se označava specifična toplota isparavanja latinično pismo L. Mjeri se u džulima po kilogramu (J/kg). Može se izvesti dijeljenjem topline koja se troši na isparavanje s masom tekućine:
Ova vrijednost je veoma važna za proizvodnih procesa zasnovano moderne tehnologije. Njime se, na primjer, rukovode u proizvodnji metala. Ispostavilo se da ako se željezo topi, a zatim kondenzira, nastaje jača kristalna rešetka daljnjim stvrdnjavanjem.
Šta je jednako
Vrijednost specifične topline za različite tvari (r) određena je tokom laboratorijska istraživanja. Voda normalna atmosferski pritisak ključa na 100 °C, a toplota isparavanja vode je 2258,2 kJ/kg. Ovaj pokazatelj za neke druge supstance dat je u tabeli:
| Supstanca | tačka ključanja, °C | r, kJ/kg |
|---|---|---|
| Nitrogen | -196 | 198 |
| Helijum | -268,94 | 20,6 |
| Vodonik | -253 | 454 |
| Kiseonik | -183 | 213 |
| Karbon | 4350 | 50000 |
| Fosfor | 280 | 400 |
| Metan | -162 | 510 |
| Pentane | 36 | 360 |
| Iron | 2735 | 6340 |
| Bakar | 2590 | 4790 |
| Tin | 2430 | 2450 |
| Olovo | 1750 | 8600 |
| Cink | 907 | 1755 |
| Merkur | 357 | 285 |
| Zlato | 2 700 | 1 650 |
| Etanol | 78 | 840 |
| Metil alkohol | 65 | 1100 |
| Hloroform | 61 | 279 |
Međutim, ovaj indikator se može promijeniti pod utjecajem određenih faktora:
- Temperatura. Kako se povećava, toplina isparavanja se smanjuje i može biti nula.
t, °C r, kJ/kg 2500 10 2477 20 2453 50 2380 80 2308 100 2258 200 1940 300 1405 374 115 374,15 - Pritisak. Kako pritisak opada, toplina isparavanja se povećava i obrnuto. Tačka ključanja je direktno proporcionalna pritisku i može doseći kritičnu vrijednost od 374 °C.
p, Pa bp, °C r, kJ/kg 0,0123 10 2477 0,1234 50 2380 1 100 2258 2 120 2202 5 152 2014 10 180 1889 20 112 1638 50 264 1638 100 311 1316 200 366 585 220 373,7 184,8 Kritično 221.29 374,15 - - Masa supstance. Količina topline uključena u proces direktno je proporcionalna masi rezultirajuće pare.
Odnos isparavanja i kondenzacije
Fizičari su otkrili da proces obrnutog isparavanja - kondenzacije - para troši potpuno istu količinu energije koliko je potrošena na njeno formiranje. Ovo zapažanje potvrđuje zakon održanja energije.
Inače bi bilo moguće napraviti instalaciju u kojoj bi tečnost isparavala, a zatim kondenzovala. Razlika između topline potrebne za isparavanje i topline dovoljne za kondenzaciju dovela bi do akumulacije energije koja bi se mogla iskoristiti u druge svrhe. U stvari, stvorio bi se vječni motor. Ali to je suprotno fizičkim zakonima i stoga nemoguće.
Kako se mjeri
- Specifična toplota isparavanja vode se eksperimentalno meri u fizičkim laboratorijama. Za to se koriste kalorimetri. Procedura je sljedeća:
- U kalorimetar se ulije određena količina tekućine.
Vrenje je intenzivno isparavanje koje nastaje kada se tečnost zagreva ne samo sa površine, već i unutar nje.
Do ključanja dolazi uz apsorpciju topline.
Večina dovedena toplota se troši na razbijanje veza između čestica supstance, ostatak se troši na rad koji se vrši prilikom širenja pare.
Kao rezultat, energija interakcije između čestica pare postaje veća nego između čestica tekućine, pa je unutrašnja energija pare veća od unutrašnje energije tekućine na istoj temperaturi.
Količina topline potrebna za prevođenje tekućine u paru tokom procesa ključanja može se izračunati pomoću formule:

gdje je m masa tečnosti (kg),
L je specifična toplota isparavanja.
Specifična toplota isparavanja pokazuje koliko je toplote potrebno da se 1 kg date supstance pretvori u paru na tački ključanja. Jedinica specifične toplote isparavanja u SI sistemu:
[ L ] = 1 J/kg
Kako pritisak raste, temperatura ključanja tečnosti raste, a specifična toplota isparavanja opada, i obrnuto.

Tokom ključanja temperatura tečnosti se ne menja.
Tačka ključanja zavisi od pritiska koji se vrši na tečnost.
Svaka supstanca na istom pritisku ima svoju tačku ključanja.
Sa povećanjem atmosferskog pritiska, ključanje počinje na više visoke temperature, obrnuto kada se pritisak smanji.
Na primjer, voda ključa na 100°C samo pri normalnom atmosferskom pritisku.
ŠTA SE DEŠAVA UNUTAR TEČNOSTI PRILIKOM KURANJA?

Vrenje je prelazak tečnosti u paru uz kontinuirano stvaranje i rast mehurića pare u tečnosti, unutar kojih tečnost isparava. Na početku zagrevanja voda je zasićena vazduhom i ima sobnu temperaturu. Kada se voda zagrije, plin otopljen u njoj oslobađa se na dnu i zidovima posude, stvarajući mjehuriće zraka. Počinju se pojavljivati mnogo prije ključanja. Voda isparava u ove mjehuriće. Mjehur ispunjen parom počinje da se naduvava na dovoljno visokoj temperaturi.

Reaching određene veličine odvaja se od dna, diže se na površinu vode i puca. U tom slučaju para napušta tečnost. Ako voda nije dovoljno zagrijana, tada mjehur pare, koji se diže u hladne slojeve, kolabira. Rezultirajuće fluktuacije vode dovode do pojave ogromnog broja malih mjehurića zraka u cijeloj zapremini vode: takozvani "bijeli ključ".

Deluje vazdušni mehur zapremine na dnu posude sila dizanja:
Fpod \u003d Farchimede - Fgravitacija
Mjehurić je pritisnut na dno, jer sile pritiska ne djeluju na donju površinu. Kada se zagrije, mjehur se širi zbog oslobađanja plina u njega i odvaja se od dna kada je sila podizanja nešto veća od sile pritiska. Veličina mjehurića koji se može odvojiti od dna ovisi o njegovom obliku. Oblik mjehurića na dnu određen je vlažnošću dna posude.
Nehomogenost vlaženja i spajanje mjehurića na dnu dovelo je do povećanja njihove veličine. At velike veličine Kada se iza njega diže mjehur, nastaju praznine, praznine i vrtlozi.
Kada mehur pukne, sva tečnost koja ga okružuje juri ka unutra i nastaje prstenasti talas. Zatvarajući, ona izbacuje stub vode.

Kada se rasprsnuti mjehurići kolabiraju u tekućini, šire se udarni valovi ultrazvučnih frekvencija, praćeni zvučnim šumom. Za početne faze ključanje karakteriziraju najglasniji i najviši zvuci (u fazi "bijelog ključa" kotlić "pjeva").
(izvor: virlib.eunnet.net)
GRAF TEMPERATURE PROMJENA AGREGATNIH STANJA VODE

POGLEDAJTE POLICU KNJIGA!
ZANIMLJIVO
Zašto postoji rupa na poklopcu čajnika?
Za ispuštanje pare. Bez otvora na poklopcu, para može prskati vodu preko grla čajnika.
___
Trajanje kuhanja krumpira, počevši od trenutka ključanja, ne ovisi o snazi grijača. Trajanje je određeno vremenom zadržavanja proizvoda na tački ključanja.
Snaga grijača ne utječe na tačku ključanja, već samo na brzinu isparavanja vode.
Kuvanje može dovesti do smrzavanja vode. Da biste to učinili, potrebno je ispumpati zrak i vodenu paru iz posude u kojoj se nalazi voda, tako da voda cijelo vrijeme ključa.
"Lonci lako proključaju preko ivice - do lošeg vremena!"
Pad atmosferskog pritiska koji prati pogoršanje vremena razlog je što mlijeko brže "bježi".
___
Vrlo vruća kipuća voda može se dobiti na dnu dubokih rudnika, gdje je pritisak zraka mnogo veći nego na površini Zemlje. Dakle, na dubini od 300 m voda će ključati na 101 ͦ C. Uz pritisak vazduha od 14 atmosfera, voda ključa na 200 ͦ C.
Ispod zvona vazdušne pumpe možete dobiti "ključalu vodu" na 20 ͦ C.
Na Marsu bismo pili "ključalu vodu" na 45 C.
Slana voda ključa iznad 100 ͦ C. ___
U planinskim predelima na znatnoj visini, pod sniženim atmosferskim pritiskom, voda ključa na temperaturama nižim od 100 ͦ Celzijusa.

Čekanje da se takvo jelo skuha traje duže.
Sipajte hladno...i proključaće!
Normalno, voda ključa na 100 stepeni Celzijusa. Zagrijte vodu u tikvici na gorioniku do ključanja. Hajde da ugasimo gorionik. Voda prestaje da ključa. Tikvicu zatvaramo čepom i počinjemo pažljivo ulijevati hladnu vodu na čep. Šta je? Voda ponovo ključa!
..............................ispod mlaza hladnom vodom malo vode u tikvici, a sa njom i vodena para počinje da se hladi.
Volumen pare se smanjuje, a pritisak iznad površine vode se mijenja...
Šta mislite, u kom pravcu?
... Tačka ključanja vode pri sniženom pritisku je manja od 100 stepeni, a voda u tikvici ponovo ključa!
____
Prilikom kuvanja pritisak unutar lonca - "preslona" - je oko 200 kPa, a supa u takvom loncu kuhaće se mnogo brže.
Možete uvući vodu u špric do otprilike pola, zatvoriti ga istim čepom i oštro povući klip. U vodi će se pojaviti puno mjehurića, što ukazuje da je započeo proces ključanja vode (i to na sobnoj temperaturi!).
___
Kada supstanca pređe u gasovito stanje, njena gustina se smanjuje za oko 1000 puta.
___
Prvi električni kotlovi imali su grijače ispod dna. Voda nije dolazila u kontakt sa grijačem i ključala je jako dugo. Godine 1923. Arthur Large je napravio otkriće: stavio je grijač u specijalnu bakrenu cijev i stavio ga u kotlić. Voda je brzo proključala.
Samohlađene limenke za bezalkoholna pića razvijene su u SAD. U teglu je postavljen pretinac sa tečnošću niskog ključanja. Ako kapsulu zgnječite po toplom danu, tečnost će početi ubrzano da ključa, oduzimajući toplotu sadržaju tegle, a za 90 sekundi temperatura napitka pada za 20-25 stepeni Celzijusa.
ZAŠTO?
Mislite li da je moguće tvrdo skuvati jaje ako voda ključa na temperaturi nižoj od 100 stepeni Celzijusa?
____
Hoće li voda ključati u loncu koji pluta u drugom loncu s kipućom vodom?
Zašto? ___
Možete li natjerati vodu da proključa bez zagrijavanja?

Vrenje je, kao što smo vidjeli, također isparavanje, samo što je praćeno brzim stvaranjem i rastom mjehurića pare. Očigledno je da je tokom ključanja tečnosti potrebno dovesti određenu količinu toplote. Ova količina toplote ide na stvaranje pare. Štaviše, različite tečnosti iste mase zahtevaju različite količine toplote da bi se pretvorile u paru na tački ključanja.
Eksperimenti su pokazali da je za isparavanje vode težine 1 kg na temperaturi od 100 °C potrebno 2,3 x 10 6 J energije. Za isparavanje 1 kg etra uzetog na temperaturi od 35 °C potrebno je 0,4 10 6 J energije.
Dakle, kako se temperatura tekućine koja isparava ne bi promijenila, tekućini mora biti dovedena određena količina topline.
Fizička veličina koja pokazuje koliko je topline potrebno da se tekućina mase 1 kg pretvori u paru bez promjene temperature naziva se specifična toplina isparavanja.
Specifična toplota isparavanja označena je slovom L. Njena jedinica je 1 J/kg.
Eksperimentima je utvrđeno da je specifična toplota isparavanja vode na 100 °C 2,3 10 6 J/kg. Drugim riječima, potrebno je 2,3 x 10 6 J energije da se 1 kg vode pretvori u paru na temperaturi od 100 °C. Dakle, na tački ključanja, unutrašnja energija supstance u stanju pare je veća od unutrašnje energije iste mase supstance u tečnom stanju.
Tabela 6
Specifična toplota isparavanja određenih supstanci (na tački ključanja i normalnom atmosferskom pritisku)
U kontaktu sa hladnim predmetom dolazi do kondenzacije vodene pare (Sl. 25). U tom slučaju se oslobađa energija apsorbirana tokom stvaranja pare. Precizni eksperimenti pokazuju da, kada se kondenzuje, para daje količinu energije koja je ušla u njeno formiranje.

Rice. 25. Kondenzacija pare
Posljedično, kada se 1 kg vodene pare na temperaturi od 100 °C pretvori u vodu iste temperature, oslobađa se 2,3 x 10 6 J energije. Kao što se vidi iz poređenja sa drugim supstancama (tabela 6), ova energija je prilično visoka.
Energija koja se oslobađa prilikom kondenzacije pare može se iskoristiti. U velikim termoelektranama para koja se koristi u turbinama zagrijava vodu.
Ovako zagrijana voda koristi se za grijanje zgrada, u kupatilima, praonicama i za druge kućne potrebe.
Da biste izračunali količinu toplote Q koja je potrebna za pretvaranje tečnosti bilo koje mase, uzete na tački ključanja, u paru, morate pomnožiti specifičnu toplotu isparavanja L sa masom m:
Iz ove formule se može utvrditi da
m=Q/L, L=Q/m
Količina topline koju oslobađa para mase m, koja se kondenzira na tački ključanja, određena je istom formulom.
Primjer. Koliko je energije potrebno da se 2 kg vode na 20°C pretvori u paru? Zapišimo stanje problema i riješimo ga.

Pitanja
- Kolika je energija koja se dovodi do tečnosti tokom ključanja?
- Koja je specifična toplota isparavanja?
- Kako se može eksperimentalno pokazati da se energija oslobađa kada se para kondenzira?
- Kolika je energija koju oslobađa 1 kg vodene pare prilikom kondenzacije?
- Gdje se u tehnologiji koristi energija koja se oslobađa prilikom kondenzacije vodene pare?
Vježba 16
- Kako shvatiti da je specifična toplota isparavanja vode 2,3 10 6 J/kg?
- Kako shvatiti da je specifična toplota kondenzacije amonijaka 1,4 10 6 J/kg?
- Koja od supstanci navedenih u tabeli 6, kada se iz tečnog stanja prevede u paru, ima više povećanje unutrašnje energije? Obrazložite odgovor.
- Koliko je energije potrebno da se 150 g vode pretvori u paru na 100°C?
- Koliko energije treba utrošiti da bi voda mase 5 kg, uzeta na temperaturi od 0°C, proključala i isparila?
- Koju će količinu energije osloboditi voda mase 2 kg kada se ohladi sa 100 na 0 °C? Kolika će se količina energije osloboditi ako umjesto vode uzmemo istu količinu pare na 100 °C?
Vježba
- Prema tablici 6 odredite kod koje od tvari, kada se iz tekućeg stanja pretvore u paru, unutrašnja energija jače raste. Obrazložite odgovor.
- Pripremite izvještaj o jednoj od tema (opciono).
- Kako nastaju rosa, mraz, kiša i snijeg.
- Kruženje vode u prirodi.
- Metalno livenje.
