Vesinikkloriidhappe aurustumissoojuse erisoojuse väärtus. Keetmine. Aurustumise erisoojus
Aine vedelast olekust gaasiliseks muutmise protsessi nimetatakse aurustamine. Aurustamist saab läbi viia kahe protsessina: i.
Keetmine
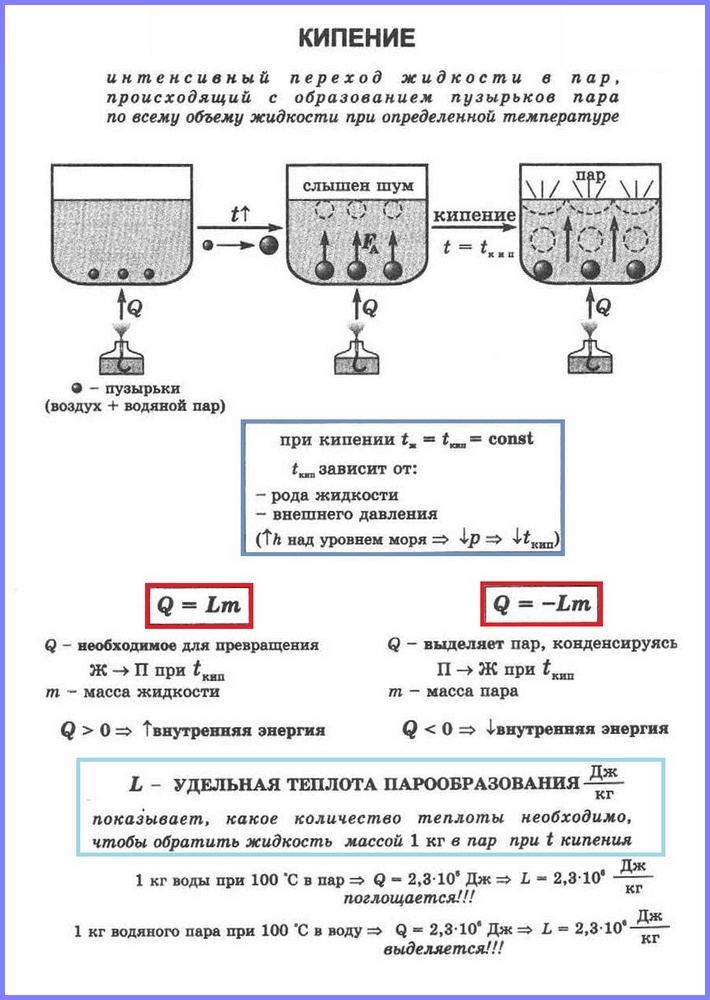
Teine aurustumisprotsess on keetmine. Saate seda protsessi vaadata koos lihtne kogemus vee soojendamine klaaskolvis. Vee kuumutamisel tekivad sellesse mõne aja pärast mullid, mis sisaldavad õhku ja küllastunud veeauru, mis tekib mullide sees vee aurustumisel. Kui temperatuur tõuseb, suureneb rõhk mullide sees ja üleslükkejõu mõjul tõusevad need üles. Kuna aga ülemiste veekihtide temperatuur on madalam kui alumistes, hakkab aur mullides kondenseeruma ja need tõmbuvad kokku. Kui vesi soojeneb kogu mahu ulatuses, tõusevad auruga mullid pinnale, lõhkevad ja aur väljub. Vesi keeb. See toimub temperatuuril, mille juures rõhk küllastunud aur mullid on võrdne atmosfäärirõhuga.
Nimetatakse aurustumisprotsessi, mis toimub kogu vedeliku mahus teatud temperatuuril. Temperatuuri, mille juures vedelik keeb, nimetatakse keemispunkt.
See temperatuur sõltub atmosfäärirõhust. Atmosfäärirõhu tõustes tõuseb keemistemperatuur.
Kogemused näitavad, et keemisprotsessi ajal vedeliku temperatuur ei muutu, hoolimata sellest, et energia tuleb väljast. Vedeliku üleminek gaasilisse olekusse keemistemperatuuril on seotud molekulide vahelise kauguse suurenemisega ja vastavalt nendevahelise külgetõmbe ületamisega. Vedelikule antav energia kulutatakse tõmbejõudude ületamiseks. See juhtub seni, kuni kogu vedelik muutub auruks. Kuna vedeliku ja auru temperatuur on keemise ajal sama, siis keskmine kineetiline energia molekulid ei muutu, ainult nende potentsiaalne energia suureneb.
Joonisel on kujutatud vee temperatuuri ja aja graafikut selle kuumutamisel toatemperatuurilt keemiseni (AB), keetmisel (BC), auruga kuumutamisel (CD), auruga jahutamisel (DE), kondenseerumisel (EF) ja sellele järgneval jahutamisel (FG).
Aurustumise erisoojus
Erinevate ainete muundamiseks vedelast olekust gaasiliseks on vaja erinevat energiat, seda energiat iseloomustab väärtus, mida nimetatakse aurustumiserisoojuseks.
Erisoojus aurustamine (L) on väärtus, mis võrdub soojushulga suhtega, mis tuleb anda ainele massiga 1 kg, et see keemistemperatuuril vedelast olekust gaasiliseks muutuks.
Eriaurumissoojuse ühik on [ L] = J/kg.
Soojushulga Q arvutamiseks, mis tuleb anda ainele massiga mn, et see muutuks vedelast olekust gaasiliseks, on vajalik aurustumissoojus ( L) korda aine mass: Q = Lm.
Auru kondenseerumisel eraldub teatud kogus soojust ja selle väärtus on võrdne soojushulga väärtusega, mis tuleb kulutada vedeliku auruks muutmiseks samal temperatuuril.
Vee (või muu vedeliku) keemise säilitamiseks on vaja seda pidevalt soojusega varustada, näiteks kuumutada põletiga. Sel juhul ei tõuse vee ja anuma temperatuur, vaid iga ajaühiku kohta tekib teatud kogus auru. Sellest järeldub järeldus, et vee muutumine auruks nõuab soojuse juurdevoolu, nii nagu see toimub kristalli (jää) muutumisel vedelikuks (§ 269). Soojushulka, mis on vajalik vedeliku massiühiku muutmiseks sama temperatuuriga auruks, nimetatakse antud vedeliku aurustumissoojuseks. Seda väljendatakse džaulides kilogrammi kohta.
On hästi näha, et auru vedelikuks kondenseerumisel peab eralduma sama palju soojust. Tõepoolest, langetagem boileriga ühendatud toru veeklaasi (joonis 488). Mõni aeg pärast kuumutamise algust hakkavad vette kastetud toru otsast välja tulema õhumulle. See õhk tõstab veidi vee temperatuuri. Seejärel läheb boileris vesi keema, misjärel näeme, et toru otsast väljuvad mullid ei tõuse enam üles, vaid vähenevad kiiresti ja terav heli kaduma. Need on veeks kondenseeruvad aurumullid. Niipea, kui katlast väljub õhu asemel aur, hakkab vesi kiiresti soojenema. Nagu erisoojus aur on ligikaudu sama, mis õhk, siis sellest vaatlusest järeldub, et nii kiire vee kuumenemine toimub just auru kondenseerumise tõttu.

Riis. 488. Samal ajal kui katlast õhku tuleb, näitab termomeeter peaaegu sama temperatuuri. Kui õhu asemel väljub aur ja hakkab tassis kondenseeruma, tõuseb termomeeter kiiresti, mis näitab temperatuuri tõusu.
Kui ühik auru mass kondenseerub sama temperatuuriga vedelikuks, vabaneb soojushulk, mis on võrdne aurustumissoojusega. Seda võiks ette näha energia jäävuse seaduse alusel. Tõepoolest, kui see nii ei oleks, siis oleks võimalik ehitada masin, milles vedelik kõigepealt aurustub ja seejärel kondenseerub: aurustumissoojuse ja kondenseerumissoojuse vahe oleks kõigi kehade koguenergia juurdekasv. osaleda vaadeldavas protsessis. Ja see on vastuolus energia jäävuse seadusega.
Aurustumiserisoojuse saab määrata kalorimeetri abil sarnaselt sellega, kuidas seda tehakse sulamiserisoojuse määramisel (§ 269). Valage kalorimeetrisse teatud kogus vett ja mõõtke selle temperatuur. Seejärel juhime mõnda aega katsevedeliku auru katlast vette, võttes meetmeid, et voolaks ainult aur, ilma vedelikupiiskadeta. Selleks juhitakse aur läbi auruti (joonis 489). Pärast seda mõõdame kalorimeetris uuesti vee temperatuuri. Kalorimeetrit kaaludes saame selle massi suurenemise järgi hinnata vedelikuks kondenseerunud auru kogust.

Riis. 489. Sukhoparnik - seade auruga koos liikuvate veepiiskade kinnihoidmiseks
Kasutades energia jäävuse seadust, saame koostada selle protsessi võrrandi soojusbilanss, mis võimaldab määrata vee aurustumise erisoojust. Olgu vee mass kalorimeetris (kaasa arvatud kalorimeetri veeekvivalent) võrdne auru massiga - , vee soojusmahutavusega - , kalorimeetris oleva vee alg- ja lõpptemperatuuriga - ja keemistemperatuuriga vesi – ja aurustumise erisoojus – . Soojusbilansi võrrandil on vorm
![]() .
.
Mõnede vedelike aurustumiserisoojuse määramise tulemused normaalrõhul on toodud tabelis. 20. Nagu näete, on see kuumus üsna suur. Vee kõrge aurustumissoojus mängib looduses äärmiselt olulist rolli, kuna aurustumisprotsessid toimuvad looduses suurejooneliselt.
Tabel 20. Mõnede vedelike erisoojus
|
Aine |
Aine |
||
|
etanool) |
|||
Pange tähele, et tabelis olevad aurustumissoojuse erisoojuse väärtused viitavad keemistemperatuurile normaalne rõhk. Kui vedelik keeb või lihtsalt aurustub erineval temperatuuril, on selle aurustumissoojus erinev. Vedeliku temperatuuri tõustes aurustumissoojus alati väheneb. Selle selgitust vaatame hiljem.
295.1. Määrake soojushulk, mis on vajalik keemistemperatuurini kuumutamiseks ja 20 g vee auruks muutmiseks.
295.2. Millise temperatuuri saadakse, kui 200 g vett sisaldavasse klaasi lastakse temperatuuril 3 g auru? Ignoreeri klaasi soojusmahtuvust.
Me kõik teame, et veekeetjas keeb vesi 100 °C juures. Kuid kas olete märganud, et vee temperatuur keemise ajal ei muutu? Küsimus on - kuhu kaob tekkiv energia, kui hoiame anumat pidevalt tules? See muudab vedeliku auruks. Seega on vee gaasilisse olekusse üleminekuks vajalik pidev soojusvarustus. Kui palju on vaja kilogrammi vedeliku muutmiseks sama temperatuuriga auruks, määrab füüsikaline suurus, mida nimetatakse vee erisoojuseks.
Koguse füüsiline tähendus
Keetmine nõuab energiat. Suurem osa sellest kasutatakse purustamiseks keemilised sidemed aatomite ja molekulide vahel, mille tulemusena tekivad aurumullid ja väiksem läheb auru paisutama, ehk et tekkinud mullid saaksid lõhkeda ja selle vabastada. Kuna vedelik suunab kogu oma energia üleminekuks gaasilisse olekusse, saavad selle "jõud" otsa. Energia pidevaks uuenemiseks ja keemise pikendamiseks tuleb vedelikuga anumasse tuua järjest rohkem soojust. Selle sissevoolu võib tagada boiler, gaasipõleti või mõni muu. kütteseade. Keemise ajal vedeliku temperatuur ei tõuse, toimub sama temperatuuriga auru moodustumise protsess.
Vaja on erinevaid vedelikke erinev summa auruks muutmiseks soojendage. Milline - näitab aurustumissoojust.
Saate aru, kuidas see väärtus määratakse näitest. Võtke 1 liiter vett ja laske keema tõusta. Seejärel mõõdame kogu vedeliku aurustamiseks vajaliku soojushulga ja saame vee eriaurumissoojuse väärtuse. Teistele keemilised ühendid see näitaja on erinev.
Füüsikas tähistatakse aurustumise erisoojust Ladina täht L. Seda mõõdetakse džaulides kilogrammi kohta (J/kg). Selle saab tuletada, jagades aurustumisele kulunud soojuse vedeliku massiga:
See väärtus on väga oluline tootmisprotsessid põhineb kaasaegsed tehnoloogiad. Näiteks juhinduvad nad sellest metallide tootmisel. Selgus, et kui raud sulatada ja seejärel kondenseerida, siis edasise kõvenemisega tekib tugevam kristallvõre.
Mis on võrdne
Ajal määrati erisoojuse väärtus erinevatele ainetele (r). laboriuuringud. Vesi normaalsel tasemel atmosfääri rõhk keeb 100 °C juures ja vee aurustumissoojus on 2258,2 kJ/kg. See indikaator mõne muu aine puhul on toodud tabelis:
| Aine | keemistemperatuur, °C | r, kJ/kg |
|---|---|---|
| Lämmastik | -196 | 198 |
| Heelium | -268,94 | 20,6 |
| Vesinik | -253 | 454 |
| Hapnik | -183 | 213 |
| Süsinik | 4350 | 50000 |
| Fosfor | 280 | 400 |
| metaan | -162 | 510 |
| Pentaan | 36 | 360 |
| Raud | 2735 | 6340 |
| Vask | 2590 | 4790 |
| Tina | 2430 | 2450 |
| Plii | 1750 | 8600 |
| Tsink | 907 | 1755 |
| elavhõbe | 357 | 285 |
| Kuldne | 2 700 | 1 650 |
| Etanool | 78 | 840 |
| Metüülalkohol | 65 | 1100 |
| Kloroform | 61 | 279 |
Kuid see näitaja võib teatud tegurite mõjul muutuda:
- Temperatuur. Selle suurenedes aurustumissoojus väheneb ja võib olla null.
t, °C r, kJ/kg 2500 10 2477 20 2453 50 2380 80 2308 100 2258 200 1940 300 1405 374 115 374,15 - Surve. Rõhu langedes suureneb aurustumissoojus ja vastupidi. Keemistemperatuur on otseselt võrdeline rõhuga ja võib jõuda kriitilise väärtuseni 374 °C.
p, Pa bp, °C r, kJ/kg 0,0123 10 2477 0,1234 50 2380 1 100 2258 2 120 2202 5 152 2014 10 180 1889 20 112 1638 50 264 1638 100 311 1316 200 366 585 220 373,7 184,8 Kriitiline 221,29 374,15 - - Aine mass. Protsessis osalev soojushulk on otseselt võrdeline tekkiva auru massiga.
Aurustumise ja kondenseerumise suhe
Füüsikud on avastanud, et vastupidine aurustumisprotsess – kondenseerumine – kulutab aur täpselt sama palju energiat, kui kulus selle tekkele. See tähelepanek kinnitab energia jäävuse seadust.
Vastasel juhul oleks võimalik luua installatsioon, milles vedelik aurustuks ja seejärel kondenseeruks. Aurustamiseks vajaliku soojuse ja kondenseerumiseks piisava soojuse vahe tooks kaasa energia akumuleerumise, mida saaks kasutada muuks otstarbeks. Tegelikult tekiks igiliikur. Kuid see on vastuolus füüsikaliste seadustega ja seetõttu võimatu.
Kuidas seda mõõdetakse
- Vee erisoojust mõõdetakse eksperimentaalselt füüsikalistes laborites. Selleks kasutatakse kalorimeetreid. Protseduur on järgmine:
- Kalorimeetrisse valatakse teatud kogus vedelikku.
Keemine on intensiivne aurustumine, mis tekib siis, kui vedelikku kuumutatakse mitte ainult pinnalt, vaid ka selle sees.
Keemine toimub soojuse neeldumisel.
Enamik tarnitud soojusest kulub aineosakeste vaheliste sidemete lõhkumisele, ülejäänu kulub auru paisumisel tehtavale tööle.
Selle tulemusena muutub auruosakeste vaheline interaktsioonienergia suuremaks kui vedelate osakeste vahel, seega on auru siseenergia suurem kui vedeliku siseenergia samal temperatuuril.
Keemisprotsessi ajal vedeliku auruks ülekandmiseks vajaliku soojushulga saab arvutada järgmise valemi abil:

kus m on vedeliku mass (kg),
L on aurustumissoojus.
Aurustumise erisoojus näitab, kui palju soojust on vaja 1 kg antud aine muutmiseks keemistemperatuuril auruks. Eriaurumissoojuse ühik SI-süsteemis:
[L ] = 1 J/kg
Rõhu tõustes tõuseb vedeliku keemistemperatuur, aurustumise erisoojus väheneb ja vastupidi.

Keemise ajal vedeliku temperatuur ei muutu.
Keemistemperatuur sõltub vedelikule avaldatavast rõhust.
Igal ainel sama rõhu all on oma keemistemperatuur.
Atmosfäärirõhu tõusuga hakkab keema rohkem kõrge temperatuur, vastupidi, kui rõhk väheneb.
Näiteks vesi keeb 100°C juures ainult normaalsel atmosfäärirõhul.
MIS TOIMUB VEDELUSE SEES KEEEMISEL?

Keemine on vedeliku üleminek auruks koos vedelikus pidevate aurumullide tekke ja kasvuga, mille sees vedelik aurustub. Kütmise alguses on vesi õhuga küllastunud ja toatemperatuuril. Vee kuumutamisel eraldub selles lahustunud gaas anuma põhjas ja seintes, moodustades õhumulle. Need hakkavad ilmuma kaua enne keetmist. Vesi aurustub nendeks mullideks. Auruga täidetud mull hakkab piisavalt kõrgel temperatuuril paisuma.

Jõudes teatud suurused see murdub põhjast lahti, tõuseb veepinnale ja puruneb. Sel juhul lahkub aur vedelikust. Kui vett ei kuumutata piisavalt, kukub külmadesse kihtidesse tõusev aurumull kokku. Sellest tulenevad vee kõikumised põhjustavad tohutul hulgal väikeseid õhumulle kogu veekogus: nn valge võti.

Anuma põhjas oleva mahuga õhumull toimib tõstejõud:
Fpod \u003d Farchimede - gravitatsioon
Mull surutakse põhja, kuna survejõud ei mõju alumisele pinnale. Kuumutamisel mull paisub gaasi eraldumise tõttu ja puruneb põhjast, kui tõstejõud on vajutamisest veidi suurem. Põhjast lahti murduva mulli suurus sõltub selle kujust. Põhjas olevate mullide kuju määrab anuma põhja märguvus.
Ebahomogeensuse niisutamine ja mullide ühinemine põhjas tõi kaasa nende suuruse suurenemise. Kell suured suurused Kui mull selle taha tõuseb, tekivad tühimikud, lüngad ja keerised.
Kui mull lõhkeb, tormab kogu seda ümbritsev vedelik sissepoole ja tekib rõngakujuline laine. Sulgedes viskab ta veesamba püsti.

Kui mullid vedelikus kokku varisevad, levivad ultraheli sagedusega lööklained, millega kaasneb kuuldav müra. Sest esialgsed etapid keetmist iseloomustavad kõige valjemad ja kõrgeimad helid ("valge võtme" staadiumis veekeetja "laulab").
(allikas: virlib.eunnet.net)
TEMPERATUURI GRAAFIK VEE KOONDOLEKUTES MUUTUSTE

VAATA RAAMATURIIULIT!
HUVITAV
Miks on teekannu kaanes auk?
Auru vabastamiseks. Kui kaanes pole auk, võib aur voolata vett üle veekeetja tila.
___
Kartulite keetmise kestus, alates keetmise hetkest, ei sõltu küttekeha võimsusest. Kestus määratakse toote viibimisaja järgi keemistemperatuuril.
Küttekeha võimsus ei mõjuta keemistemperatuuri, vaid ainult vee aurustumise kiirust.
Keetmine võib vee külmuda. Selleks on vaja vee asukohast anumast õhku ja veeauru välja pumbata, et vesi kogu aeg keeks.
"Potid keevad kergesti üle ääre – halva ilma peale!"
Ilmastiku halvenemisega kaasnev õhurõhu langus on põhjus, miks piim kiiremini "ära jookseb".
___
Väga kuuma keeva vett saab sügavate kaevanduste põhjast, kus õhurõhk on palju suurem kui Maa pinnal. Nii et 300 m sügavusel keeb vesi 101 ͦ C. Õhurõhul 14 atmosfääri keeb vesi 200 ͦ C.
Õhupumba kella all saate 20 °C "keeva vett".
Marsil jooksime "keeva vett" 45 C juures.
Soolane vesi keeb üle 100 ͦ C. ___
Mägistes piirkondades, mis asuvad märkimisväärsel kõrgusel ja madalamal atmosfäärirõhul, keeb vesi temperatuuril alla 100 Celsiuse kraadi.

Sellise söögi valmimise ootamine võtab kauem aega.
Valage see külmaks ... ja see läheb keema!
Tavaliselt keeb vesi 100 kraadi Celsiuse järgi. Kuumutage kolvis olev vesi põleti peal keemiseni. Lülitame põleti välja. Vesi lõpetab keemise. Suleme kolvi korgiga ja hakkame ettevaatlikult korgile külma vett valama. Mis see on? Vesi keeb jälle!
..............................joa all külm vesi natuke vett kolbi ja koos sellega hakkab veeaur jahtuma.
Auru maht väheneb ja rõhk veepinna kohal muutub...
Mis sa arvad, mis suunas?
... Vee keemistemperatuur alandatud rõhul on alla 100 kraadi ja vesi kolvis läheb uuesti keema!
____
Küpsetamise ajal on potis – "survekeedis" - umbes 200 kPa rõhk ja supp valmib sellises potis palju kiiremini.
Võite tõmmata vett süstlasse umbes poole võrra, sulgeda see sama korgiga ja tõmmata järsult kolbi. Vette ilmub palju mullid, mis näitavad, et vee keetmine on alanud (ja see on toatemperatuuril!).
___
Kui aine läheb gaasilisse olekusse, väheneb selle tihedus umbes 1000 korda.
___
Esimestel elektrikateldel olid põhja all küttekehad. Vesi ei puutunud kerisega kokku ja kees väga kaua. 1923. aastal tegi Arthur Large avastuse: ta asetas spetsiaalsesse vasktorusse küttekeha ja asetas selle veekeetja sisse. Vesi kees kiiresti.
USA-s on välja töötatud isejahtuvad karastusjookide purgid. Purki on paigaldatud madalal temperatuuril keeva vedelikuga kamber. Kui purustate kapsli palaval päeval, hakkab vedelik kiiresti keema, võttes purgi sisult soojuse ära ja 90 sekundiga langeb joogi temperatuur 20-25 kraadi võrra.
MIKS?
Kas arvate, et muna on võimalik kõvaks keeta, kui vesi keeb alla 100 kraadi Celsiuse järgi?
____
Kas vesi keeb potis, mis ujub teises keeva vee potis?
Miks? ___
Kas on võimalik vett keema panna ilma seda kuumutamata?

Keetmine, nagu nägime, on ka aurustumine, ainult sellega kaasneb kiire aurumullide teke ja kasv. On ilmne, et keetmise ajal on vaja vedelikku viia teatud kogus soojust. See soojushulk läheb auru moodustamiseks. Veelgi enam, erinevad sama massiga vedelikud vajavad keemistemperatuuril auruks muutmiseks erinevat soojushulka.
Katsed on näidanud, et 1 kg kaaluva vee aurustamiseks temperatuuril 100 °C on vaja 2,3 x 10 6 J energiat. Temperatuuril 35 °C võetud 1 kg eetri aurustamiseks on vaja 0,4 10 6 J energiat.
Seega, et aurustuva vedeliku temperatuur ei muutuks, tuleb vedelikule anda teatud kogus soojust.
Füüsikalist suurust, mis näitab, kui palju soojust on vaja 1 kg massiga vedeliku auruks muutmiseks ilma temperatuuri muutmata, nimetatakse aurustumiserisoojuseks.
Aurustumise erisoojus on tähistatud tähega L. Selle ühik on 1 J / kg.
Katsetega on kindlaks tehtud, et vee erisoojus 100 °C juures on 2,3 10 6 J/kg. Teisisõnu kulub 1 kg vee auruks muutmiseks temperatuuril 100 °C 2,3 x 10 6 J energiat. Seetõttu on keemistemperatuuril auruolekus oleva aine siseenergia suurem kui sama massiga aine siseenergia vedelas olekus.
Tabel 6
Teatud ainete aurustumissoojus (keemistemperatuuril ja normaalsel atmosfäärirõhul)
Kokkupuutel külma esemega veeaur kondenseerub (joonis 25). Sel juhul vabaneb auru moodustumisel neeldunud energia. Täpsed katsed näitavad, et kondenseerumisel eraldab aur selle moodustumiseks kulunud energiahulga.

Riis. 25. Auru kondenseerumine
Järelikult, kui 1 kg veeauru muudetakse temperatuuril 100 °C sama temperatuuriga veeks, vabaneb 2,3 x 10 6 J energiat. Nagu on näha võrdlusest teiste ainetega (tabel 6), on see energia üsna suur.
Kasutada saab auru kondenseerumisel vabanevat energiat. Suurtes soojuselektrijaamades soojendab turbiinides kasutatav aur vett.
Sel viisil soojendatud vett kasutatakse hoonete kütmiseks, vannides, pesumajades ja muudeks olmevajadusteks.
Mis tahes massiga vedeliku keemistemperatuuril vedeliku auruks muutmiseks vajaliku soojushulga Q arvutamiseks peate korrutama aurustumissoojuse L massiga m:
Selle valemi järgi saab kindlaks teha, et
m = Q/L, L = Q/m
Sama valemiga määratakse ka keemistemperatuuril kondenseeruva massiga m auru poolt eralduv soojushulk.
Näide. Kui palju energiat kulub 2 kg 20°C vee auruks muutmiseks? Paneme kirja ülesande seisukorra ja lahendame selle.

Küsimused
- Mis energiat saab vedelik keemise ajal?
- Mis on aurustumissoojus?
- Kuidas saab katseliselt näidata, et auru kondenseerumisel vabaneb energia?
- Kui palju energiat vabaneb 1 kg veeauru kondenseerumisel?
- Kus tehnikas kasutatakse veeauru kondenseerumisel vabanevat energiat?
16. harjutus
- Kuidas peaks aru saama, et vee erisoojus on 2,3 10 6 J/kg?
- Kuidas peaks aru saama, et ammoniaagi kondensatsiooni erisoojus on 1,4 10 6 J/kg?
- Millistel tabelis 6 loetletud ainetel on vedelast olekust auruks muutmisel siseenergia suurem? Põhjenda vastust.
- Kui palju energiat kulub 150 g vee auruks muutmiseks 100°C juures?
- Kui palju energiat tuleb kulutada, et 5 kg massiga vett, mis on võetud temperatuuril 0 °C, keema ajada ja aurustada?
- Kui palju energiat eraldab 2 kg massiga vesi, kui see jahutatakse 100 °C-lt 0 °C-ni? Kui palju energiat eraldub, kui vee asemel võtta sama palju auru 100 °C juures?
Harjutus
- Tabeli 6 järgi määrake, milliste ainete vedelast olekust auruks muutmisel suureneb siseenergia tugevamini. Põhjenda vastust.
- Koostage aruanne ühel teemal (valikuline).
- Kuidas tekib kaste, härmatis, vihm ja lumi.
- Vee ringkäik looduses.
- Metalli valamine.
